Die Begriffe Antigen und Antikörper werden in der Regel im Zusammenhang mit immunologischen Prozessen verwendet und haben dort auch ihren Ursprung. Wir werden weiter unten diese Fachwörter verwenden, wenn wir die Bedeutung der molekularen Individualität für die Selbst-Fremd-Unterscheidung kennenlernen und solch praktische Gebiete der Immunologie wie Schutzimpfung, Transfusion und Transplantation streifen.
Antigene. Definitionsgemäß sind Antigene Stoffe, die in einem fremden Organismus eine Immunreaktion auslösen können. Sie führen unter anderem zur Bildung von Antikörpern, die spezifisch gegen Strukturen dieser Moleküle gerichtet sind und folglich mit diesen reagieren können. Dies können Moleküle anderer Tierarten als auch allele Strukturen der gleichen Tierart sein, wie es bei der experimentellen und klinischen Organtransplantation der Fall ist.
Der Begriff Antigen wird vielfach doppelsinnig verwendet: Es ist damit der Auslöser der Immunantwort gemeint und gleichzeitig die molekulare Zielstruktur der Produkte der Immunantwort (Antikörper, Killerzellen). Deshalb spricht man heute besser von Immunogenen anstelle von Antigenen, wenn man die Fähigkeit zur Induktion einer Immunantwort meint und von Epitopen, wenn man die Zielstruktur der Antikörper im Auge hat. Aufgrund der Tatsache, daß sich manche Begriffe über viele Jahrzehnte eingebürgert haben, werden wir im folgenden Text den Terminus Antigen gleichsinning verwenden.
Was verbirgt sich hinter dem Begriff Antigen? Antigene können lösliche Makromoleküle aus den Körperflüssigkeiten (z.B. Blutserum) oder solche aus dem Zytoplasma im Inneren der Zellen sein sowie membrangebundene Moleküle, die dem Untersucher an der Oberfläche der Plasmamembran von Zellen und Geweben begegnen wie etwa die „Blutgruppensubstanzen“ auf den Erythrozyten, die Oberflächenmoleküle in der Zellwand der Bakterien oder Glykoproteine der Virushülle oder die bereits behandelten Differenzierungsantigene.
Oftmals wird irrtümlich angenommen, daß das gesamte Virus oder das gesamte Bakterium als ein Antigen zu betrachten sei, das eine Immunantwort auslöst. Das ist natürlich nicht ganz falsch, aber genau genommen sind es einzelne unterschiedliche Moleküle der Viren oder Bakterien oder sogar nur Teile dieser Moleküle die „immunogen“ sind. Um immunogen zu sein, d.h. in einem fremden Organismus eine Immunantwort auslösen zu können, müssen die Antigene eine bestimmte Größe bzw. ein bestimmtes minimales Molekulargewicht haben.
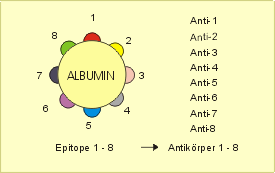
Spritzen wir beispielsweise einem Kaninchen mehrfach eine Lösung ein, die ein reines Eiweiß (z.B. Albumin vom Menschen) enthält, so erhalten wir ein Kaninchen-Serum mit Antikörpern gegen Albumin vom Menschen. Bei genauerer Analyse würden wir allerdings feststellen, daß es sich um ein Gemisch von Antikörpern handelt, das gegen verschiedene „Stellen“ eines einzelnen Albuminmoleküls reagiert. Heute weiß man, daß es auf dem kleinen Humanalbuminmolekül acht verschiedene „Stellen“, sog. Epitope oder Determinanten, gibt, die die Synthese jeweils einer Antikörperspezifität bewirken (Abb. 32).
Diese Epitope kann man sich als Vertiefungen oder Erhöhungen des Albuminmoleküls vorstellen, also als räumliche, mehr oder weniger definierte Teilabschnitte der Polypeptidkette, aus denen das kugelige Eiweißmolekül besteht. Im physikochemischen Sinne handelt es sich dabei um räumliche Ladungsmuster, die nur zu bestimmten „Gegenmustern“ passen. Wie wir im weiteren sehen werden, sind diese Epitope u.a. wichtige Träger der molekularen Individualität (z.B. Gewebeantigene).
![Chemotypen und Salmonellen [52]](https://meine-molekuele.de/wp-content/uploads/2023/06/abb36_chemotypen-219x300.png)
Differenzierungsantigene. Betrachten wir die Oberfläche einer Zelle: Unter dem Einfluß mannigfaltiger Wachstumshormone unterliegen alle unsere Körperzellen einem Reifeprozeß von der undifferenzierten Stammzelle bis zur voll funktionstüchtigen spezialisierten Organzelle. Dieser Prozeß kann durch die Analyse der Epitopmuster auf der Plasmamembran von verschiedenen Körperzellen analytisch verfolgt werden. Dabei durchlaufen die Muster der Membranproteine mannigfache Wandlungen.
Viele Proteine der Zellmembran werden entsprechend einer internationalen CD-Nomenklatur (CD = Cluster of differentiation = Differenzierungsmuster) benannt, die heute bereits mehr als 300 verschiedene strukturell und funktionell gut definierte Differenzierungsmoleküle allein für die weißen Blutzellen (Leukozyten) umfaßt. Dabei sind die dynamischen Veränderungen des Spektrums der Membranproteine im Verlaufe der Zelldifferenzierung ein anschauliches Beispiel für das ständige koordinierte An- und Abschalten der Gene während dieses Reifungsprozesses.
TODO: CD-Marker von Lymphocyten HIER MUSS NOCH EIN BILD REIN

Abb. 34 demonstriert an einem groben Schema diesen Prozeß anhand der Veränderung einiger ausgewählter Differenzierungsantigene bei der Reifung verschiedener Lymphozyten-Populationen von der Stammzelle im Knochenmark bis zur ausdifferenzierten aktiven Immunzelle. Sie macht deutlich, wie stark die Variabilität der molekularen Muster in jedem Moment des Individuallebens einer Zelle zu Tage treten kann. In der Diagnostik und Klassifizierung lymphoproliferativer Erkrankungen (Blutkrebs, Leukämie) gehört die Kenntnis des Differenzierungsstadiums der sich krebsartig vermehrenden Immunzellen anhand der Muster der Membranepitope zu den wichtigsten Voraussetzungen zur Abschätzung des Heilungserfolges und der Festlegung entsprechender Therapien (vgl.Abschnitt „Krebsmoleküle“)
Antikörper (Immunglobuline). Alle Antikörper haben prinzipiell den gleichen Aufbau. Antikörper sind Eiweiße. Sie bestehen aus jeweils zwei kurzen Polypeptidketten (leichte Ketten oder light chains, L-Ketten) mit etwa 220 Aminosäuren und zwei langen Polypeptidketten (schwere Ketten oder heavy chains, H-Ketten) mit etwa 440 Aminosäuren (Abb. 35). Die Ketten werden über Schwefelbrücken zusammengehalten. Die Antikörper zirkulieren im Blutkreislauf und gelangen auf diese Weise über die feinen Blutkapillaren in alle Körpergewebe.
In der Elektrophorese wandern die Antikörper überwiegend aufgrund ihrer negativen Ladung in der Gammafraktion der Globuline und haben diesem Umstand ihren zweiten Namen zu verdanken: Immunglobuline. Die Begriffe Immunglobuline und Antikörper werden meist synonym gebraucht. Wichtig zu merken ist, daß es sich bei den Antikörpern um Eiweiße handelt.
So ist eine weitere scheinbar verwirrende und von Schülern und Studenten gefürchtete Frage diese: Können Antikörper auch Antigene sein? Klare Antwort, ja, natürlich (im wahrsten Sinne des Wortes). Da es sich um ein Eiweiß mit einem ausreichenden Molekulargewicht handelt, um eine Immunantwort auszulösen, können beispielsweise Antikörper vom Menschen im Kaninchen oder der Maus die Bildung von spezifischen Anti-Antikörpern (Anti-Immunglobulinen) anregen.
Die Aminosäuren-Sequenzanalyse der Immunglobuline zeigt, daß die leichte als auch die schwere Kette einen Abschnitt (grün) aufweist, der bei allen Antikörpern eines Individuums – unabhängig davon, gegen welches Epitop der jeweilige Antikörper gerichtet ist – konstant ist. Hier befinden sich jene Epitope (kleine grüne Kreise) des Antikörpermoleküls , die es als Immunglobulin und als Antigen mit seinen Alleleigenschaften charakterisieren. Letztere weisen darauf hin, daß die Antikörper, unabhängig davon, gegen welche Antigene sie auch gerichtet sind, von Individuum zu Individuum unterschiedlich sein können (vgl. Abschnitt „Polymorphismus“).
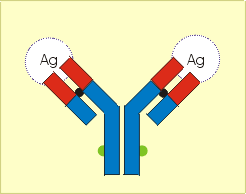
Am entgegengesetzten Ende der schweren als auch der leichten Polypeptidkette befindet sich jeweils ein Abschnitt (rot), dessen Aminosäureseqenz von Antikörperspezifität zu Antikörperspezifität variabel ist. Diese Variabilität in der Aminosäurenzusammensetzung und -sequenz bewirkt im Antikörpermolekül eine unterschiedliche Faltung des Moleküls. So entsteht an bestimmten Stellen des Antikörpermoleküls eine räumliche Struktur, die komplementär zur Gestalt der Epitope ist, die die Immunreaktion ausgelöst haben.
Dies ist der Ort, an dem die spezifische Antigen-Antikörperreaktion nach dem Schlüssel-Schloss-Prinzip stattfindet (Abb. 36). Er wird aus Abschnitten der variablen Aminosäuresequenzen der schweren und leichten Kette gebildet. In Abhängigkeit von der Antikörperklasse (IgG, IgA, IgM, IgD, IgE) können Antikörper in monomerer, dimerer oder pentamerer Form mit 2, 4 oder 10 Bindungsstellen auftreten, an die sich die Antigene/Epitope binden können (Abb. 36). Auf diese Weise wird eine Vernetzung (Präzipitation, Agglutination) löslicher oder an Zellstrukturen gebundener Antigene/Epitope ermöglicht.
Antikörperspezifität. Zuletzt soll uns noch eine Frage beschäftigen, auf die bis heute noch keine abschließende Antwort gegeben werden konnte und deren Beantwortung zur hohen Schule der Immunologie gehört. Vereinfacht könnte die Frage lauten: Wie ist es möglich, daß nach einer Immunisierung genau die Antikörper entstehen, die spezifisch gegen das Immunogen (Antigen) gerichtet sind, das zur Immunisierung verwendet wurde? Und weiter: Warum unterbleiben in der Regel Reaktionen gegen körpereigene Moleküle (vgl. Abschnitt „Autoaggression„)? Interessante Fragen, die eng mit der molekularen Individualität zusammenhängen. Das Thema füllt dicke Fachbücher und beschäftigt tausende von Wissenschaftler weltweit. Es soll hier nur kurz angerissen werden.
Eine wichtige feststehende Tatsache ist die Erkenntnis, daß eine Immunzelle nur Antikörper mit einer einzigen Spezifität, z.B. gegen ein Epitop, bilden kann. Alle von dieser Zelle abstammenden Tochterzellen (Klon) bilden Antikörper mit der gleichen Spezifität. Daraus ergibt sich folgerichtig die Frage, ob es bereits zum Zeitpunkt der Geburt Immunzellen gegen alle möglichen zu erwartenden Immunogene gibt und die spezifisch vorgeprägten Immunzellen nur noch nach Antigenkontakt klonal vermehrt werden oder ob die Spezifität der Antiköper erst durch den Antigenkontakt induziert wird.
Wie meistens in solchen Fällen nährt sich die Wahrheit von Teilen der verschiedenen Theorien. Kurz gesagt, scheint es bereits zum Zeitpunkt der Geburt eine Vielzahl von aktiven Genen für die Kodierung einer großen Anzahl von „Anti-Strukturen“, den späteren Antigen-Bindungsstellen, zu geben, für die man zu diesem Zeitpunkt einen noch „unreifen“ Status postuliert. Nach Antigenkontakt „reift“ die Spezifität der Antikörper, verbunden mit der Fähigkeit, festere Bindungen mit „seinen“ Antigenstrukturen einzugehen. Das Ganze spielt sich ursächlich auf der Ebene der DNS ab. Dabei erfolgt eine „Umgruppierung“ bestimmter DNS-Abschnitte, die durch entsprechende Zellhormone bewirkt wird. Dieser Prozeß wird somatische Rekombination (Tonegawa, Nobelpreis 1987) genannt und unterscheidet sich von der weiter oben behandelten Rekombination bei der Entstehung der Keimzellen dahingehend, daß diese genomischen Veränderungen nicht in die Keimbahn gelangen und somit nicht auf die Nachkommen weitergegeben werden.
Bleibt noch die Frage, warum das Immunsystem in der Regel nicht gegen körpereigene Moleküle reagiert, ein Phänomen, das Landsteiner in den frühen Jahren der Immunologie (1930) als Horror autotoxicus bezeichnete. Eine der weit verbreiteten Theorien ist die Klon-Selektionstheorie (Sir Mcfarlane Burnett, Nobelpreis 1960), die davon ausgeht, daß in der Embryonalphase all jene Immunzellen ausgesondert (selektiert) werden, deren Abkömmlinge (Klone) eine Immunreaktion gegen körpereigene Moleküle bewirken könnten. Heute weiß man, daß es sich dabei sicher nur um eine funktionelle Stummschaltung bestimmter Gene handelt. Das Auftreten einer Vielzahl von Autoimmunkrankheiten zeugt davon, daß diese Stummschaltung eher ein reversibler Prozeß ist, der jederzeit umkehrbar ist (vgl. Abschnitt “ Autoaggression „).
Monoklonale Antikörper. Aufgrund ihrer hohen Spezifität eignen sich Antikörper ausgezeichnet als analytisches Werkzeug (engl. chemical tool), mit dem es möglich ist, das Vorhandensein bestimmter Antigene in Körperflüssigkeiten oder deren Lokalisation in oder auf Zellen nachzuweisen. Meist handelt es sich um sogenannte polyklonale Antiseren, die gegen mehrere Epitope eines Bakteriums oder Virus gerichtet sind.
Heute ist es jedoch möglich, kommerziell sog. monoklonale Antikörper für Therapie und Diagnostik herzustellen, die spezifisch gegen einzelne Epitope von Molekülen aus Bakterien, Viren, pflanzlichen oder tierischen Zellen oder Körperflüssigkeiten gerichtet sind. Das Verfahren zur Herstellung solcher Präparate besteht darin, daß eine Suspension mit einem Gemisch antikörperproduzierender Zellen (meist von der Maus) unterschiedlicher Epitopspezifität so stark verdünnt wird, daß in den Untersuchungsgefäßen nur noch eine einzige antikörperproduzierende Zelle – mit einer Spezifität für ein einzelnes Epitop – vorhanden ist. Nach Fusion mit einer Tumorzelle synthetisiert der Klon des Fusionsprodukts in der Zellkultur nur noch Antikörper mit einer einzelnen Epitopspezifität. Monoklonale Antikörper finden in vielen kommerziell hergestellten hochspezifischen Testsystemen Anwendung und haben u.a. in hohem Maße dazu beigetragen, den Zusammenhang zwischen Epitopmustern auf Gewebezellen und Zelldifferenzierung aufzuklären.
Antikörper als „Werkzeug (chemical tool)“. Nachfolgend soll das Prinzip von drei modernen, häufig verwendeten Testverfahren vorgestellt werden, mit denen auch die meisten der weiter unten beschriebenen Phänomene untersucht wurden. Auch hier finden wir wieder die Anwendung des Schlüssel-Schloss-Prinzips zum Nachweis individueller molekularer Strukturen. Reaktionspartner sind hier die komplementären Strukturen von Antigen-Bindungsstelle des Antikörpers und Epitop des Antigenmoleküls.
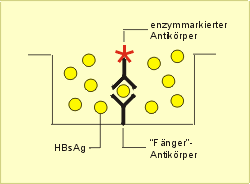
1. Nachweis eines Antigens in einer Serumprobe (Beispiel: Hepatitis-B-Serum-Antigen [HBsAg])
Ablauf: (1) Anheften eines spezifischen „Fänger“-Antikörpers gegen HBsAg an die Testplatte (2) Zugabe des verdünnten Serums des Probanden (Antikörper „fängt“ HBsAg aus der Serumprobe [Abb. 37]). (3) Inkubation und danach Auswaschen der Testplatte mit Puffer (4) Zugabe eines enzymmarkierten spezifischen Antikörpers gegen HBsAg (5) Reaktion und danach Auswaschen der Testplatte mit Puffer (6) Zugabe von Substrat (das an den Antikörper gebundene Enzym setzt das farblose Substrat zu einer Farblösung um) (7) Visuelle Bewertung der Farbreaktion (positiv/negativ) oder photometrische Messung (Abb. 38). Die Reaktion kann auch quantitativ unter Verwendung entsprechender Eichreihen durchgeführt werden.
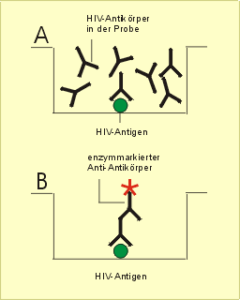
2. Nachweis eines spezifischen Antikörpers in einer Serumprobe (Beispiel: Anti-HIV-Test)(Abb. 39)
Ablauf: A (1) Anheften des HIV-Antigens an die Testplatte (2) Zugabe des verdünnten Serums des Probanden (3) Reaktion und danach Auswaschen der Testplatte mit Puffer; B (4) Zugabe eines enzymmarkierten Anti-Immunglobulins (5-7); weiter wie bei Hepatitis-Antigen.
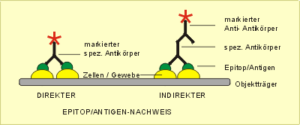
3. Nachweis von Antigenen an der Oberfläche von Einzelzellen oder an einem Gewebeschnitt
A – Direkte Methode (Abb. 40 links)
Benötigt wird ein Gewebeschnitt oder eine Zellsuspension und ein monospezifischer Antikörper gegen das nachzuweisende Antigen, wobei der Antikörper zum Sichtbarmachen der positiven Antigen-Antikörperreaktion mit einem Enzym oder einem Fluoreszenzfarbstoff markiert ist.
Ablauf: (1) Reaktion des fluoreszenz- oder enzymmarkierten monospezifischen Antikörpers mit dem Zellmaterial (2) Abspülen der Probe, (3) Enzymreaktion. Betrachten des Präparates unter dem Lichtmikroskop oder bei Verwendung eines fluoreszenzmarkierten Antikörpers unter dem Fluoreszenzmikroskop oder elektronische Auswertung mit speziellen Zählgeräten (z.B. Durchflußzytometer).
B – Indirekte Methode (Abb. 40 rechts)
Ablauf: (1) Reaktion des unmarkierten monospezifischen (primären) Antikörpers mit dem Zellmaterial (2) Abspülen der Probe (3) Zugabe eines enzym- bzw. fluoreszenzmarkierten (sekundären) Anti-Antikörpers, der mit dem in der primären Reaktion gebundenen Antikörper reagiert. (4) Enzymreaktion und Betrachten unter dem Lichtmikroskop. Der große Vorteil der indirekten Methode besteht darin, daß die meist sehr teuren monospezifischen Primärantikörper nicht markiert werden müssen, was in den meisten Fällen mit großen Verlusten verbunden ist. Ein zweiter Vorteil ist, daß für alle Primärantikörper der gleiche Sekundärantikörper verwendet werden kann, vorausgesetzt die Primärantikörper stammen von der gleichen Tierart.
Die oben beschriebenen serologischen Methoden zum Antikörpernachweis sind heute aus der klinischen Routinediagnostik nicht mehr wegzudenken. Sie können mit wenig Probenmaterial und großer Probenanzahl halb- oder vollautomatisiert durchgeführt werden. Aufwendiger sind Methoden zum Nachweis von Antigenen an Zelloberflächen oder im Zellinneren, insbesondere, wenn es sich um lebende Zellen handelt. Sie sind in der Regel Speziallaboratorien vorbehalten und spielen in der Forschung verschiedener Biowissenschaften und in der medizinischen Forschung eine wichtige Rolle.
Fazit: Antigene (Immunogene) sind Stoffe, die in einem fremden Organismus eine Immunreaktion auslösen können. Vielfach sind es Eiweiße (Proteine) oder zusammengesetzte Eiweiße mit anderen Stoffklassen (Glyko-, Lipo-, Nukleoproteide). Dabei kann es sich um lösliche Moleküle handeln oder solche, die an der Oberfläche von Zellmembran auftreten.
Antikörper sind Eiweiße und Produkte einer Immunreaktion. Sie sind in der Regel spezifisch gegen die komplementären Strukturen des Antigens/Epitops gerichtet, das ihre Synthese ausgelöst hat. Aufgrund ihrer hohen Spezifität eignen sie sich zur Anwendung in vielen diagnostischen Verfahren.
